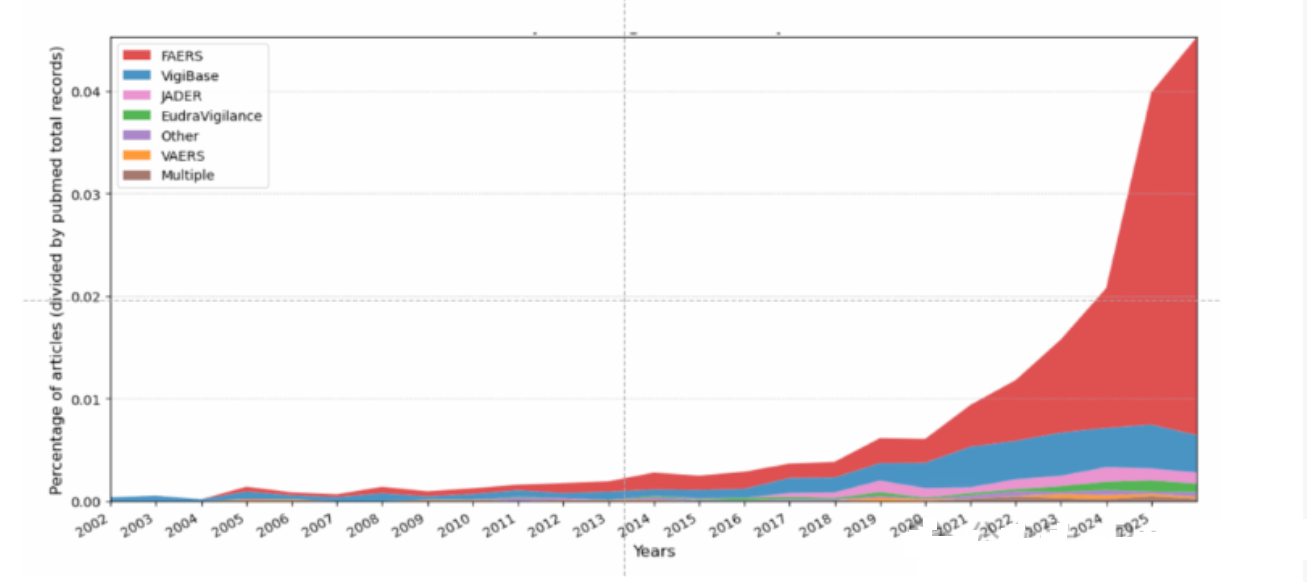
FAERS 是 FDA 公开数据库,含 3180 万条由医护人员、患者提交的药物不良反应记录,原本用于监测新药安全信号。2021 年,基于该数据库的药物安全研究仅约 100 篇;到 2024 年,这类论文激增至 600 篇,2025 年至今发表量已超去年。
2025 年 9 月,法国格勒诺布尔阿尔卑斯大学医院药理学家 Charles Khouri 团队在预印本(9 月 14 日发布)中披露了一个学界 “怪象”:近三年来,基于美国 FDA 药物不良反应报告系统(FAERS)的药物安全研究论文数量暴增,部分期刊不堪重负,已出台拒收或严格审核政策。

Frontiers in Pharmacology 和 Expert Opinion on Drug Safety 是这类论文的主要发表平台。
其中,Expert Opinion on Drug Safety(由泰勒 & 弗朗西斯集团出版)2021 年全年论文总量,仅相当于 2024 年该刊发表的 174 篇 FAERS 相关论文数 —— 这类论文占其 2024 年总发表量的近 60%。而 Frontiers in Pharmacology 2023 年发表约 30 篇 FAERS 论文,2024 年直接突破 120 篇。

“这些论文把单纯的统计关联当成‘安全信号’,可能引发不必要的恐慌,影响医护人员诊疗和患者用药行为。”Khouri 在预印本中指出。更关键的是,FAERS 存在天然缺陷:不良反应报告是自愿提交的,仅占实际发生量的未知比例,且药物新颖度、媒体关注等都会影响报告率,直接用其做研究易出误导性结论。
面对论文 “洪水”,两本期刊先后行动。2025 年 7 月底,Expert Opinion on Drug Safety 宣布,不再接受未经邀请的、基于 FAERS 或类似自发报告数据库的 “ disproportionality analysis( disproportionality 分析,用于挖掘药物未知副作用)” 类论文,仅考虑编辑部主动邀请的稿件。该刊发言人透露,此类论文投稿量激增后,即便加派人手审核,拒稿率仍超 80%,且常存在方法学问题。
另一本期刊 Frontiers in Pharmacology 则从审核标准入手。2025 年 5 月,Frontiers 集团要求旗下所有期刊对 “健康数据库研究” 实施 “独立外部验证”,此前 2024 年 7 月已对类似研究设过验证门槛。据该集团研究诚信负责人 Elena Vicario 介绍,2024 年 7 月至今,Frontiers in Pharmacology 已拒收 739 篇 FAERS 相关投稿,仅 9 篇通过 2025 年更新后的审核。
Khouri 团队还发现这类论文的更多 “异常”:2019-2025 年发表在 Expert Opinion on Drug Safety 的 FAERS 论文中,近 80% 作者来自中国机构,而 2021 年前中国作者几乎未涉足该领域;部分作者频繁发文,如四川大学 Bin Wu 发表 27 篇相关研究(7 篇刊于该刊),同校 Li Chen、郑州大学 Wei Liu 也有多篇;论文常存在方法冗余(如用多种统计方法做同一分析)、图表重复(如无用的 “发病时间镜像图”),甚至有研究将 “西地那非(治疗肺动脉高压药物)与肺动脉高压关联为不良反应”,暴露对药物认知不足。
学界担忧,这类论文不仅浪费科研经费 —— 可能让研究者投入精力验证虚假信号,更会误导医患。英国萨里大学讲师 Matt Spick 在 2025 年 7 月 9 日 MedrXiv 预印本中指出,FAERS 等开放数据库 + 生成式 AI,已成为 “论文工厂” 批量产文的工具,他此前还发现另一数据库 NHANES 也存在类似论文激增问题。

目前,仅有两篇 FAERS 相关论文被撤稿:一篇因未经作者同意署名(2025 年 8 月,Expert Opinion on Drug Safety),另一篇因涉嫌 “论文工厂” 操作(BioMed Research International)。Khouri 坦言,这类论文难因 “欺诈” 撤稿,“结果无意义、存在 P 值操纵,但不算伪造,只是无用”。
眼下,Khouri 团队正进一步梳理论文特征,Spick 则聚焦 “论文工厂” 如何用 AI 批量生成这类研究。这场由数据库论文泛滥引发的期刊 “管控潮”,也让学界重新思考:“无意义的研究,该被允许发表吗?”







 19123189289
19123189289  dissertation@delpvip.com
dissertation@delpvip.com 渝公网安备50019002504948号
渝公网安备50019002504948号 